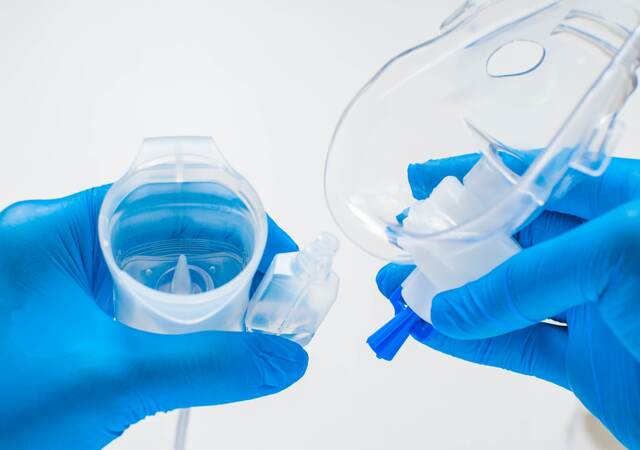
UL Solutions è leader nella valutazione della biocompatibilità effettuando test e servizi di analisi tossicologica per valutare la conformità globale di dispositivi medici per la respirazione, la ventilazione e accessori.
Siamo in grado di aiutarvi a identificare in anticipo i requisiti necessari nell’ambito dei test e della conformità, per gestire le informazioni richieste per l'ottenimento dell' autorizzazione 510(k) della FDA (Food and Drug Administration) statunitense e e facilitarne la revisione. Questo aiuta a ridurre al minimo il rischio di costosi ritardi e a rispettare il time to market.
Il processo di approvazione normativa dei dispositivi medici è complesso e non sempre ben definito. L'FDA è l'agenzia federale responsabile della supervisione normativa dei dispositivi medici negli Stati Uniti. La maggior parte delle revisioni preliminari alla messa in commercio dei dispositivi medici condotte dall'FDA rientra nel programma di Notifica Pre-commercializzazione Premarket Notification 510(k). Oltre alla descrizione del dispositivo, dei dispositivi equivalenti, informazioni relative al software e ai test prestazionali, la domanda presentata per l’FDA 510(k) deve includere i dati relativi alla biocompatibilità di tutti i materiali direttamente o indirettamente a contatto con il paziente.
Molte richieste contengono informazioni inadeguate sulla biocompatibilità dei dispositivi o non forniscono affatto dati sulla biocompatibilità. Le richieste di informazioni aggiuntive ritardano il processo di revisione rallentando il time to market.
Anticipare l’esecuzione dei test e le valutazioni relative all’esposizione del paziente (exposure assessment) al dispositivo, aiuta a ottenere l'autorizzazione della FDA o dell'organismo notificato, riducendo al minimo i rischi di accumulare costosi ritardi e allungare i tempi di commercializzazione.
Test sui dispositivi medici ed exposure assessment in conformità alla norma ISO 18562
La norma ISO 18562 comprende una serie di standard che delineano i principi generali per la valutazione dei percorsi di gas all’interno di un dispositivo medico destinato a fornire cure respiratorie o somministrare gas anestetici o altre sostanze per le vie respiratorie. I test e le valutazioni secondo la serie di standard ISO 18562 sono necessari per le nuove notifiche FDA 510(k), per la conformità ai requisiti MDR (Medical Device Regulation) dell'UE e per la valutazione delle modifiche dei materiali nei prodotti esistenti.
I nostri test (compresi quelli per il particolato (PM), le sostanze organiche volatili (SOV) e le sostanze rilasciabili nel condensato) e le valutazioni dell'esposizione tossicologica valutano la conformità dei dispositivi medici soggetti alla norma ISO 18562.
Valutazione della biocompatibilità in accordo alla norma ISO 18562
Per i dispositivi respiratori e di ventilazione, una componente chiave della valutazione della biocompatibilità è la misurazione delle sostanze organiche volatili (SOV) e delle particelle che possono essere rilasciate all’interno del tratto respiratorio.
La serie di norme ISO 18562 è articolata in quattro parti:
- ISO 18562-1 - Parte 1 Valutazione e prove all’interno di un processo di gestione dei rischi
- ISO 18562-2 - Parte 2 Prove per l’emissione di materiale particolato
- ISO 18562-3 - Parte 3 Prove per l’emissione di sostanze organiche volatili (SOV)
- ISO 18562-4 - Parte 4 Prove per sostanze rilasciabili nel condensato
Dispositivi medici interessati
I metodi di prova e i requisiti di valutazione del rischio contenuti in questi standard si applicano a tutti i dispositivi medici, le parti e gli accessori che possono entrare in contatto con il percorso dei gas respirabili. L'ambito dei prodotti interessati da questi standard comprende:
- Ventilatori
- Postazioni di anestesia (compresi i miscelatori di gas)
- Sistemi di respirazione
- Apparecchiature per la conservazione dell'ossigeno
- Concentratori di ossigeno
- Nebulizzatori
- Tubi flessibili a bassa pressione
- Umidificatori
- Scambiatori di calore e umidità
- Monitor dei gas respiratori
- Monitor della respirazione
- Maschere
- Boccagli
- Rianimatori
- Tubi di respirazione
- Filtri per sistemi di respirazione
- Raccordi a Y
- Accessori
La lista dei prodotti interessati include anche gli interni delle incubatrici, compresi il materasso e la superficie interna della cappa di ossigeno.
Vantaggi di eseguire test ISO 18562 con un’organismo di terza parte
Il nostro è un team di esperti in materia di test e valutazioni della biocompatibilità dei dispositivi medici per la respirazione e ventilazione secondo la norma ISO 18562.
Siamo in grado di aiutarvi a identificare in anticipo i requisiti necessari nell’ambito dei test e della conformità, per gestire le informazioni richieste per l'autorizzazione FDA 510(k) statunitense e per la revisione da parte dell'organismo notificato, riducendo al minimo i costosi ritardi e rispettando il time to market.
*https://www.fda.gov/medical-devices/premarket-notification-510k/special-considerations-510ks
Nella sezione Notizie - Aggiornamenti normativi per i prodotti retail e di consumo
Le norme sui prodotti di consumo sono in rapida evoluzione. Iscrivetevi ora per ricevere la newsletter mensile e rimanere aggiornati sui cambiamenti normativi per la vostra azienda, per affrontare le sfide della conformità.
Contatta il nostro team commerciale
Grazie per l’interesse manifestato nei confronti dei nostri prodotti e servizi. Per metterti in contatto con la persona di riferimento, abbiamo bisogno di alcune informazioni.