醫療器材單一稽核計畫(MDSAP)整合了 ISO 13485:2016 的要求,並涵蓋五個國家的醫療器材法規:澳洲、巴西、加拿大、日本及美國。我們的 MDSAP 服務頁面詳細說明了獲得 MDSAP 證書的優勢。在本文中,我們將探討在獲得 MDSAP 證書之前需要完成的重要步驟。
為了獲得 MDSAP 證書,品質管理系統(QMS)必須符合 ISO 13485:2016 標準的所有適用要求。此外,系統還須納入/整合每個 MDSAP 成員國的醫療器材法規,並且符合該製造商目前銷售或計劃銷售醫療器材的國家要求。雖然 MDSAP 涵蓋五個成員國,但 QMS 僅需符合製造商在認證當下適用的國家要求。因此,若製造商最初僅計劃將相關器材銷往美國與澳洲,則 QMS 在首次註冊稽核時只需符合美國食品藥品監督管理局(FDA)及澳洲藥物管理局(TGA)的適用規範。未來若計劃進入其他 MDSAP 國家市場,QMS 需隨之調整以符合額外國家的法規要求,並可相應擴展證書適用範圍。
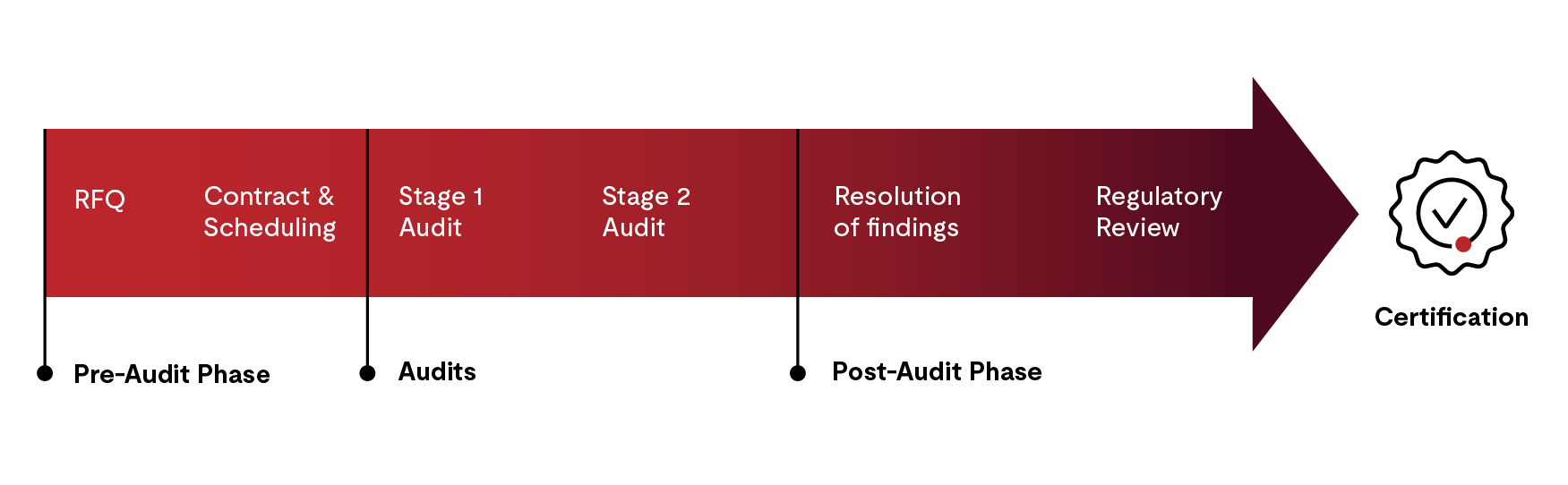
認證流程包含四個步驟:
- 稽核前階段:報價、合約簽訂與稽核排程
- 第 1 階段與第 2 階段稽核
- 稽核後活動
- 證書簽發
製造商需要充分準備,且管理團隊積極參與,才能成功完成每個步驟。

稽核前階段
在簽訂合約之前,客戶將需要提供基本資訊,包括組織與設施概況、計劃銷售的醫療器材產品、員工人數及其他細節。UL Solutions 將根據初步資訊提供報價,並在簽約前解答與報價相關的問題,包括首次註冊稽核的預計時程。若客戶接受報價,客戶與稽核機構(AO)將簽訂合約,並安排註冊稽核的時間。
第 1 階段稽核
第 1 階段稽核(S1)的主要目的是評估客戶的 QMS 是否已準備好接受 MDSAP 認證。稽核將重點關注文件化程序(SOP 及相關文件),這些文件需明確定義 QMS。SOP 應涵蓋 ISO 13485:2016 及 MDSAP 稽核方法文件(MDSAP AU P0002)所規範的所有適用流程。該文件可於 MDSAP 文件網站公開取得。QMS 應體現對 ISO 13485:2016 標準及 MDSAP 稽核方法指引的完整理解。第 1 階段稽核可現場進行或遠端執行,建議將所有 SOP 以電子格式存檔,以便遠端檢閱。此外,受稽核組織的品質手冊將成為本次稽核的重點審查對象,因為該手冊通常是 QMS 的核心文件。
需要注意的是,在部分 MDSAP 成員國,外國製造商必須透過當地機構辦理初步市場授權,而在其他國家則為選擇性要求。
- 在澳洲,外國製造商必須聘請澳洲當地代表來註冊醫療器材並向 TGA 提交申請。該代表稱為「澳洲贊助商」。
- 在巴西,外國製造商必須與當地機構合作,該機構將做為巴西註冊持有人(BRH),負責獲得在巴西的行銷授權。
- 在日本,醫療器材製造商必須委任當地代表,稱為行銷授權持有人(MAH),代表製造商與厚生勞動省溝通。
- 在加拿大,若欲銷售第 2 類及以上類別的醫療器材,製造商必須持有 MDSAP 證書。在 MDSAP 五個成員國中,目前僅加拿大對 MDSAP 證書有強制要求。但若為加拿大衛生部指定的第 1 類醫療器材,則無需 MDSAP 證書。在加拿大,外國製造商可選擇與加拿大境內的進口商合作,但並非強制要求。製造商可直接向加拿大衛生部申請醫療器材許可,或選擇聘請第三方法規顧問來協助與衛生部溝通,但這也非強制要求。
- 在美國,醫療器材製造商可直接與美國 FDA 溝通。
在 S1 稽核期間,製造商須展現對相關法規機構基本要求的瞭解。若 S1 稽核中發現任何不足,這些缺失將被反饋給客戶,並要求在第 2 階段稽核(S2)前完成改進。根據缺失程度,可能會有兩種結果:
- 認定客戶 QMS 未達到 MDSAP 要求,並可能建議進行新的 S1 稽核;或者
- 認定缺失的性質相對較為輕微,因此下一步可進入 S2 稽核階段。S2 稽核的時間安排將取決於缺失的嚴重程度,通常可在 S1 稽核後一至六個月內進行。但若缺失超過六個月仍未改善,則需重新進行 S1 稽核。
第 2 階段稽核
第 2 階段稽核(S2 稽核)為現場稽核,通常需數日完成。稽核所需的天數將在簽約前提供給製造商。此稽核依據 MDSAP 稽核方法模型進行,並依照以下結構來評估 QMS 的各個方面:
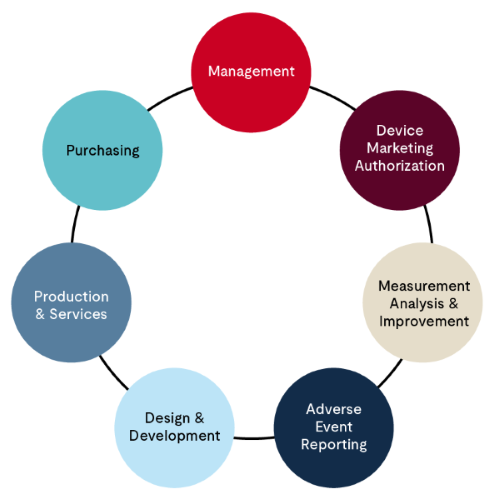
- 管理流程——此部分共分為 11 個稽核項目,主要評估 QMS 的整體架構,包括但不限於:組織架構、管理層承諾、管理審查、文件控制、人力資源與能力評估等。品質手冊為此評估的核心文件。
- 醫療器材行銷授權流程——此部分著重於在相關法規機構註冊設施以及醫療器材許可程序,分為 3 個稽核項目。這些流程通常由組織內負責 MDSAP 認證的法規專家管理。
- 量測、分析與改進——顧名思義,此部分關注 QMS 運作的監測與改進計畫,其中包含客訴處理、CAPA、內部稽核流程、不合格材料與製程管理,以及上市後監測,上述內容為核心重點。這些流程通常由組織內負責 MDSAP 認證的 QA 經理管理。
- 不良事件通報、產品召回與顧問通知——此部分包含 3 個稽核項目,並依據 MDSAP 稽核方法進行評估。這些流程通常由組織內負責 MDSAP 認證的法規事務團隊管理。
- 設計與開發流程——在 MDSAP 稽核方法中,此部分涉及 16 個稽核項目,涵蓋設計與開發新器材產品時從規劃、設計轉移至製造的完整過程,並包含設計變更管理。
- 生產與服務控制流程——在 MDSAP 稽核方法中,針對生產與服務控制流程,建議涵蓋 29 個稽核項目。此部分涉及醫療器材製造的各個環節,包括但不限於:基礎設施、工作環境、生產製程驗證、生產品質控制測試、倉儲、產品識別與追溯、不合格材料處理及銷售。
稽核後活動
稽核後活動包含兩大重點:
- 製造商須針對稽核期間識別出的不符合項進行修正;以及
- 稽核機構須進行內部法規審查,以評估稽核結果。
S1 稽核發現的不符合項,必須在 S2 稽核時完成改善、消除並驗證。若 S2 稽核仍發現不符合項,則會根據 MDSAP 要求,依 1 至 5 級進行分級。MDSAP 所採用分級機制的基本概念源自 GHTF/SG3/N19:2012。由於該 GHTF 文件早於 ISO 13485:2016 發布,因此文件內仍參照 ISO 13485:2003 標準。然而,該分級機制的原則與概念仍然適用於 MDSAP。若不符合項達到第 4 級或第 5 級,或被歸類為 ISO 13485「重大缺失」,則必須在 MDSAP 證書簽發前完成修正。
稽核團隊將稽核結果提交給內部法規審查團隊。根據審查結果,證書決策者將判定該次稽核是否達到簽發 MDSAP 證書的標準,並將最終決定通知製造商。此外,最終稽核報告也會依據 MDSAP 政策提交至 MDSAP REPS 資料庫。
MDSAP 證書必須符合 MDSAP AU P0026 的要求,且至少包含合法製造商的名稱與地址、認證範圍、適用管轄區、稽核週期起始日、證書生效日期和失效日期等資訊。通常,MDSAP 證書的有效期為三年。
為何選擇 UL Solutions 進行 MDSAP 認證?
UL Solutions 是全球應用安全科學領域的專家。身為 ISO 17021 的 UKAS 認證註冊商,UL Solutions 為多個專案提供 QMS 註冊。根據 UKAS 規定,我們提供 ISO 13485 稽核以及 ISO 13485 和 ISO 9001 的聯合稽核。
我們所有的稽核員均為 UL Solutions 的全職員工,確保 QMS 整個生命週期內的稽核體驗保持一致,並提供持續的支援。
我們位於 40 多國的 15,000 名法規稽核員與評估員,擁有豐富經驗,肩負使命,為超過100個國家的客戶提供服務。
UL 認證標誌是一個全球公認的標誌,這個標誌代表我們推進安全使命的堅定承諾。
關於作者
Chira Deka 是 UL Solutions MDSAP 計畫的專案經理,同時擔任區域審查主管、證書決策者,以及 ISO 13485、ISO 9001 和 MDSAP 認證計畫的首席稽核員。此外,他亦為 MDD 與 IVDD 計畫的首席稽核員,以及 UKCA 認證計畫的稽核員。他是 IVD 領域的技術專家,並擁有多項相關專利。他曾擔任 NIH SBIR 技術審查小組(微生物學)成員,並曾獲得 NIH 及美國商務部 ATP 研究資助,專注於 IVD 及生物技術領域。
與我們的業務團隊保持聯絡
感謝您對我們的產品和服務感興趣。請填寫相關資訊,我們將安排適合的專業人員與您聯繫。