Digitale Transformation
Die Digitalisierung verändert die Medizinprodukteindustrie. Innovation wird zunehmend durch künstliche Intelligenz (KI) und cloudbasierte intelligente digitale Gesundheitsanwendungen, Software als Medizinprodukt (SaMD) oder das Internet der medizinischen Dinge (IoMT) vorangetrieben.
Um mit der Dynamik der softwaregesteuerten Innovation Schritt halten zu können, sind neue Ansätze für die Entwicklung von Medizinprodukten und eine Überwachung nach der Markteinführung erforderlich – immer auf der Basis von Softwareengineering-Exzellenz und unter Einhaltung aller Vorschriften.
Ein digitales Ökosystem für Medizinprodukte
Um die Zeit bis zur Markteinführung zu verkürzen, stützen sich führende Medizinproduktehersteller erfolgreich auf softwarezentrierte Entwicklungsansätze.
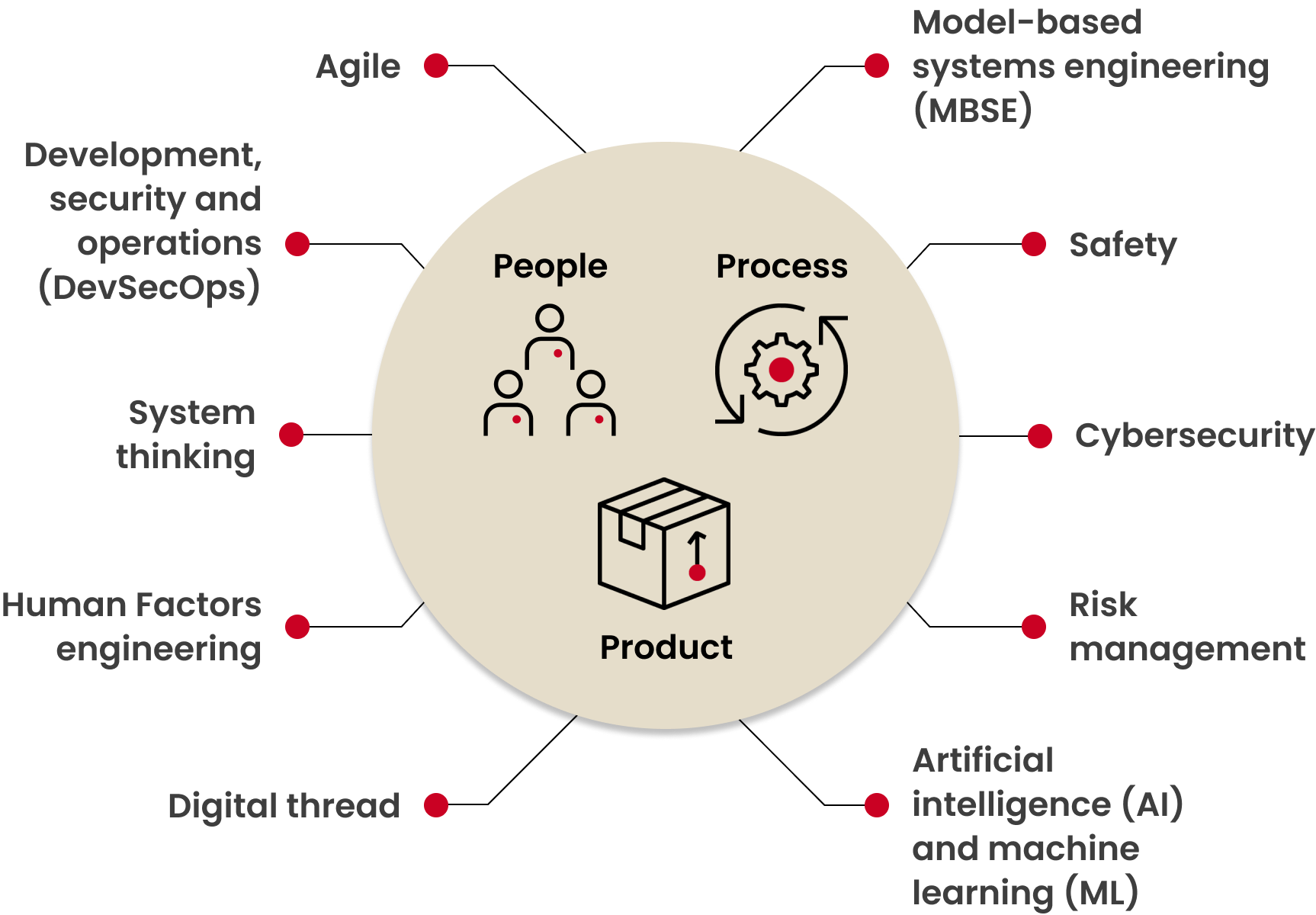
Das Bild zeigt die wichtigsten Faktoren, die den Entwurf medizinischer Software beeinflussen und verbessern. Man darf diese jedoch nicht getrennt voneinander betrachten, sondern sollte den ganzheitlichen Ansatz des Systems Engineering wählen.

Prozessmanagement für Medizinprodukte
Stages ist eine bewährte Plattform für die Erstellung und Umsetzung integrierter Prozesslandschaften, die alle wesentlichen Aspekte der Entwicklung medizinischer Software umfasst.
Stages unterstützt eine beschleunigte Produkteinführung durch:
- Modellierung verschlankter Entwicklungsprozesse
- Beschleunigung der Aneignung neuer Praktiken und Techniken
- Abbau von Silodenken der einzelnen Entwicklungsteams

Regulatorische Unterstützung
Mit Stages kann der Aufwand für den Nachweis der Einhaltung von Vorschriften und Industriestandards erheblich reduziert werden.
Es hilft Ingenieuren, sich im Umfeld der komplexen regulatorischen Anforderungen an Medizinprodukte zurechtzufinden, einschließlich derjenigen aus folgenden Vorschriften und Standards:
- U.S. Food and Drug Administration (FDA) Code of Federal Regulations (CFR) Titel 21, Teil 820.
- EU-Verordnung über Medizinprodukte (MDR)
- Internationale Elektrotechnische Kommission (IEC) 62304, Medizingeräte-Software – Software-Lebenszyklus-Prozesse.
- Internationale Organisation für Normung (ISO) 14971:2019, Medizinprodukte – Anwendung des Risikomanagements auf Medizinprodukte.
- ISO 13485:2016, Medizinprodukte – Qualitätsmanagementsysteme – Anforderungen für regulatorische Zwecke.
- IEC 82304-1, Gesundheitssoftware – Teil 1: Allgemeine Anforderungen an die Produktsicherheit.
- IEC 81001-5-1:2021, Gesundheitssoftware und Gesundheits-IT-Systeme – Sicherheit, Effektivität und Security, Teil 5-1: Sicherheit – Aktivitäten im Produktlebenszyklus.
- FDA-Anleitung: Cybersicherheit in medizinischen Geräten: Überlegungen zum Qualitätssystem und zum Inhalt von Zulassungsanträgen.
- ISO 27799: Gesundheitsinformatik – Informationssicherheitsmanagement im Gesundheitswesen bei Verwendung von ISO/IEC 27002.
Interview mit Siemens Healthineers
„Mit Stages bringen wir Menschen zusammen. Stages unterstützt uns bei der Harmonisierung unserer Prozesse und bei der Optimierung von Arbeitsabläufen unserer Engineers. “

Shamron Awwal | Senior Process Engineer | Siemens
Engineeringexzellenz
Nutzen Sie die Erfahrung unserer Ingenieure und Berater, um Exzellenz im System- und Softwareengineering für Ihre Medizinprodukte zu erreichen.
Hier finden Sie einen Auszug unserer Fachgebiete:
- Entwicklung medizinischer Software und Systeme
- Entwicklung medizinischer Software gemäß IEC 62304
- Durchführung von Risikoanalysen gemäß ISO 14971
- Implementierung von Usability-Engineeringprozessen gemäß EC 62366
- Unterstützung bei der Einrichtung von Softwareentwicklungsprozessen zur effizienten Erfüllung regulatorischer Anforderungen
- Agile Entwicklung aktiver Medizinprodukte gemäß Association for the Advancement of Medical Instrumentation® (AAMI) Technical Information Report 45 (TIR45)
Kontaktieren Sie unser Team
Vielen Dank für Ihr Interesse an unseren Produkten und Dienstleistungen. Wir würden gerne ein paar Informationen sammeln, damit wir Sie mit der richtigen Person in Kontakt bringen können.